1)
OSSIDO-REDUTTASI: catalizzano il
trasferimento di elettroni, le redox.
Meccanismo: AH + B <==> A + BH2
▪
Trasportano unità riducenti
▪ Sono
proteine coniugate (con i gruppi prostetici), che utilizzano derivati vitaminici
o strutture prodotte dalla cellula come gli emi
Si
suddividono in:
1.
piridiniche: utilizzano derivati della vitamina PP
▪ il
coenzima piridinico non è stabilmente legato alla apoproteina (parte proteica)
ma interagisce con legami deboli ▪ esso può essere nello stato ridotto (NADH o
NADPH) o ossidato (NAD+ o NADP+) ed avrà pertanto più
affinità per enzimi che devono ridurre o che devono ossidare ▪ i substrati che
interagiscono con questi enzimi sono unità monocarboniose o altri coenzimi di
tipo flavinico oppure l’O2
2.
flaviniche: utilizzano derivati della vitamina B2, riboflavina
▪ il
coenzima flavinico è stabilmente legato alla propria apoproteina con legame
covalente più o meno forte e ulteriori interazioni come legami H ▪ può essere
nello stato ridotto (FMNH2 o FADH2) o ossidato (FAD o FMN)
▪ i substrati riconosciuti sono unità bicarboniose, o altri coenzimi di tipo
piridinico o chinonico, oppure l’O2
3.
chinoniche: utilizzano derivati delle vitamine E e K, coenzimi Q
▪ data la
loro natura chimica parzialmente idrofobica, i chinoni si associano ad apoenzimi
lipoproteici, ossia proteine enzimatiche di membrana (citoplasmatica o
mitocondriale) ▪ il legame tra chinone e apoenzima è mediato da soatutuenti
idrofobici che si inseriscono in domini idrofobici che formano un solco sulla
superficie della proteina globulare ▪ la porzione reattiva del coenzima
chinonico sporge verso l’esterno
4.
pteriniche: utilizzano la pterina, precursore della vitamina B8
▪ sono
ossigenasi del tipo delle monossigenasi (un solo OH nel substrato) ▪ il legame
tra apoenzima e geruppo prostetico è di tipo covalente ▪ contengono un nucleo
pirimidinicocondensato con un nucleo piperazinico ▪ solo vegetali e
microorganismi possono sintetizzarsi la pterina, in emergenza anche gli animali
eterotrofi lo fanno
5.
vitamina C: in questo caso la vit. C non si rigenera
▪ la
vit. C si lega covalentemente al sito attivo delle sue apoproteine, che sono
sempre enzimi ossigenasici ▪ la vit. C può essere nello stato ossidato o
ridotto, ma ‘in vivo’ è difficile che essa venga di nuovo ridotta (non si
rigenera), per cui il fabbisogno è sempre molto alto ▪ solo i primati e le
cavie non la sintetizzano, tutti gli altri organismi sì ▪ il substrato
riconosciuto dalle ossido reduttasi vit C è sempre l’O2
6.
metalliche: utilizzano metalli, generalmente Fe, Cu, Mn
▪ hanno
come gruppo prostetico Fe o Cu che cambia stato redox durante il processo
(talvolta Mn e Co) ▪ agiscono con meccanismo ossigenasico (substrato O2)
▪ il metallo può essere legato a residui amminoacidici quali tyr, his o cyst, o
essere inserito all’interno di gabbie di zolfo dette
centri-ferro-zolfo contenenti zolfo
cisteinico e zolfo elementare ▪ ci sono esempi di enzimi con singolo centro
metallico (1 atomo) ed esempi di enzimi con due centri metallici (due atomi) ▪
similitudine evolutiva con pigmenti respiratori (emocianine ed emoeritrine)
7.
emiche: sono ossido reduttasi metalliche in cui il
metallo è quasi sempre Fe, ma nei procarioti anche Ni
▪ hanno
come gruppo prostetico un eme, ossia Fe inserito in una struttura tetrapirrolica
▪ il Fe, a differenza di quanto avviene nei pigmenti respiratori (Hb e Mb), può
cambiare stato di ossidazione ▪ Il Fe non partecipa mai al legame con la
proteina (unica eccezion il cyt B) ▪ esempi di tali enzimi sono: citocromi,
catalasi, perossidasi; sono sempre lipoproteine
2)
TRANSFERASI: catalizzano il
trasferimento di gruppi
Meccanismo: A + BC <==> AB + C
Possono
essere:
1.
senza gruppo prostetico :
▪ i
residui aacidici del sito attivo svolgono funzione catalitica comportandosi da
coenzimi ▪ essi destabilizzano i legami del substrato mediante meccanismi di
protonazione e deprotonazione ▪ gli aa coinvolti sono:
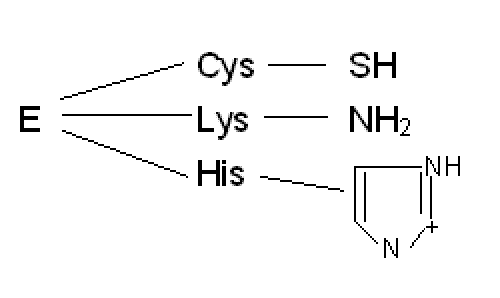
2.
con metallo come gruppo prostetico (spesso Mn):
▪
interagiscono con composti ad alta E riconoscendo legami anidridici (tra diversi
fosforili) ▪ il loro intervento serve ad aumentare il potenziale energetico di
varie molecole (es. glucosio)
3.
con vitamine B come gruppo prostetico (B1, B3, B6,
B8, B12) e un catione divalente:
■ transf. Vit. B3: ▪ hanno
come substrati sempre acili ▪ il legame tra apoproteine e coenzima è di tipo
salino (col P), quindi labile ▪ interessano il metabolismo lipidico (biosintesi
e catabolismo) ed energetico (ciclo di Krebs) ▪ utilizzano cofattori metallici.
■ transf. Vit. B1: ▪ hanno
nel gruppo prostetico oltr alla vitamina, Mn o Mg o Ca ▪
catalizzano reazioni transchetolasiche
■ transf. Vit. B6: ▪
trasferiscono gruppi NH2 ▪ i loro substrati sono: - αaa
- α-chetoacidi ▪ hanno nel sito attivo anche un metallo di transizione
▪ catalizzano transaminazione e transdesaminazioni ▪ il coenzima è un derivato
attovato della vit. B6
■ transf. Vit. B12: ▪
hanno come gruppo prostetico una struttura corrinica in cui il Co è legato ai
pirroli con: 2 legami covalenti e due legami dativi. Quando l’enzima è a riposo
esistono 2 ulteriori legami dativi con un nucleotide e con l’H2O. E’
possibile una terza covalenza per cui, quando l’enzima catalizza trasferimento
di gruppi, il substrato da trasferire si lega covalentemente al Co spostando l’H2O.
■ transf. Vit. B8: ▪
trasportano gruppi: ―CH3, ―CH ═ NH, ― CHO, ―CH2―,
―CH═ ▪
hanno come coenzima il FH4 (tetraidrofolato) derivato dalla vit. B8
▪ agiscono su accettori che sono essenzialmente gli acidi nucleici
3) IDROLASI: catalizzano
le reazioni di idrolisi (scissione dei legami tramite l’acqua).
Evolutivamente sono i più semplici perché i più antichi; sono presenti nello
stomaco e permettono la digestione, scindendo lunghe catene; servono a demolire
le macromolecole in frammentini maggiormente utilizzabili.
Meccanismo: AB + H2O <==> A + B
Tale
reazione sebbene reversibile, è spostata verso destra, poichè i prodotti sono
utilizzati, quindi sottratti all’ambiente di reazione.
▪ sono
privi di gruppo prostetico o hanno al massimo un metallo ▪ in base al tipo di
legame che viene idrolizzato avremo, (utili a scindere i principali costituenti
biologici):
1. peptidasi
2. esterasi
(- lipasi - nucleasi - fosfatasi)
3.
glicosidasi
▪
catalizzano reazioni di pseudo I ordine ▪ possono avere sede endocellulare,
generalmente in vescicole lisosomiali, o extracellulare, per digerire sostanze
nutritizie (macromolecole) o per eliminare tessuti vecchi e malati ▪ possono
esistere in forma attiva o mascherata, quest’ultima attivabile solo in
determinate condizioni (protezione dell’organismo produttore). Un enzima
mascherato si chiama anche proenzima:
struttura
in cui il sito attivo è coperto da un segmento peptidico, di varia lunghezza,
che viene rimosso a determinati pH o per intervento di altri enzimi (inattivo
→ attivo).
4)
LIASI: catalizzano la formazione o
la scissione di un legame, che può essere:
C―C, C―O,
C―N, C―S.
Meccanismo: AB <==> A + B
Essendo la
reazione reversibile l’equilibrio sarà spostato in un senso o nell’altro in base
alle necessità metaboliche del momento.
Possono
essere:
1. senza gruppo prostetico : ▪ hanno nel sito attivo un
residuo di Lys adiacente ad un residuo di His (centro catalitico) ▪
riconoscono chetosi marcati in 1 con fosfato, ed aventi C3 in configurazione L.
2. liasi metalliche: ▪ riconoscono legami: C―C (Fe), C―S
(diversi metalli), C―N (Cu), C―O (Mn)
3.
liasi a coenzima vitaminico:
■ liasi a vit. B6: ▪ sono
C―C liasi ▪ hanno sempre come substrati aa ▪ hanno funzione decarbossilante ▪
è il tipo di metallo a determinare la funzione
■ liasi a vit. B1: ▪ sono
C―C liasi ▪ hanno funzione decarbossilante ▪ hanno come substrati
unicamente α-chetoacidi ▪ possono essere enzimi solubili o legati a membrane
5) ISOMERASI:
catalizzano l’isomerizzazione, ossia il trasferimento di gruppi all’interno
delle molecole, formando isomeri. Possono trasformare reversibilmente un isomero
nell’altro:
Meccanismo: A <==>
B
▪ operano
con: - residui aacidici del sito attivo - metalli - vit
PP (coenzimi piridinici) - vit B6 -vit B12
▪ agiscono su: glicidi, aa, glicoli, acidi bicarbossilici
Possono
essere:
1. senza gruppo prostetico : ▪ realizzano l’equilibrio tra
aldosi e chetosi (es. G6P <==>
F6P) ▪ operano con aa del centro catalitico atti alla
protonazione-deprotonazione
2.
isomerasi metalliche: ▪ metallo e residuo aacidico cooperano nel sito attivo
alla catalisi ▪ sono anche dette mutasi, perchè agiscono in punti di
discriminazione metabolica a seconda delle esigenze dell’organismo
3.
liasi a coenzima vitaminico:
■ isomerasi piridiniche: ▪ riconoscono
monosaccaridi veicolati su nucleotidi difosfati ▪ operano la conversione
reversibile ad es. di glucosio in galattosio
■ isomerasi a vit. B6: ▪
agiscono sugli aa D --> L
■ isomerasi a vit. B12: ▪
agiscono su glicoli e metil malonil CoA ▪ funzione: linearizzare catene
ramificate, trasformare glicoli in aldeidi ▪ i glicoli sono strutture non
metabolizzabili, le aldeidi vengono ossidate ad acidi, i quali entrano nella β
ox (procarioti)
6) SINTETASI (LIGASI):
catalizzano le reazioni di formazione di legame, con dispendio energetico e
termodinamicamente irreversibili. Alle reazioni partecipano composti ad alta
energia (es. ATP, o NAD o altri), che vengono scissi (X •) e catalizzano le
reazioni endoergoniche.
Meccanismo: A + B + X --> AB
+ X •
Si consuma
una mole di ATP per mole di legame sintetizzato.
▪ hanno
sempre un metallo nel sito attivo (Mn o Fe) che può funzionare da solo o in
associazione a coenzimi:
-
coenzimi a legame transitorio -->
CoA
-
coenzimi a legame permanente -->
Biotina
▪
esistono:
1.
C―C ligasi
2. C―N ligasi
3. C―S ligasi
4.
C―O ligasi
5.
P―O ligasi