ENZIMI
Proteine dotate di proprietà catalitiche che non vengono consumate o alterate in
modo irreversibile nel corso di un processo biologico. Possono trovarsi nel
citoplasma (liberi all’interno della cellula), oppure nel mitocondrio o nelle
membrane cellulari.
Possono coesistere in complessi multienzimatici, ossia più enzimi diversi che
concorrono al raggiungimento di un unico scopo: spesso gli enzimi lavorano in
serie, ognuno compie un piccolo passaggio in una reazione a più fasi.
Se un enzima viene denaturato o dissociato in subunità, perde la sua attività
catalitica, così come se viene rotto nei suoi componenti amminoacidici.
[E1]
[E1]
[E1]
[F1]
CATALISI ENZIMATICA e COMPLESSO ENZIMA -
SUBSTRATO
Così come in chimica inorganica il passaggio da
reagenti a prodotti è favorito dai catalizzatori secondo la reazione:
Catalizzat.
Reag. -------------> Prod.
in chimica biologica un enzima si lega ad un substrato e agisce su di esso con
la formazione del prodotto:
enzima
Substrato ---------------->
Prod.
secondo la reazione enzimatica:
E + S <==>
ES -----> E + P
in cui il substrato, S, è la molecola su cui agisce l’enzima, e l’intermedio di
reazione, ES, è un complesso dell’enzima
con il substrato. Si può notare come l’enzima non venga consumato alla
fine della reazione e come il secondo stadio della reazione sia spostato verso
destra. Una caratteristica delle reazioni enzimatiche è quella di avvenire
all’interno dei confini di una “tasca” degli enzimi, chiamata SITO ATTIVO, che
costituisce una parte relativamente piccola dell’intera molecola enzimatica.
Questo è una complessa struttura tridimensionale formata da gruppi che fanno
parte di segmenti diversi della sequenza lineare degli amminoacidi.
L’enzima possiede un sito attivo la cui conformazione è specifica per il
substrato:
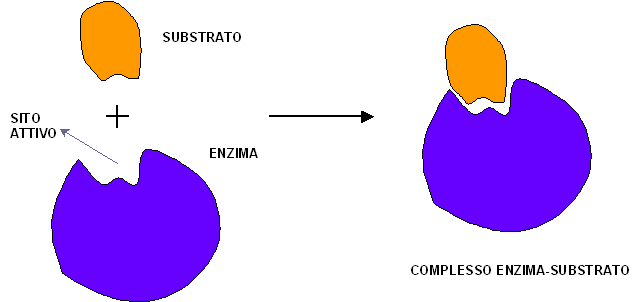
Tra enzima e substrato c’è complementarietà sterica e chimica. Un substrato deve
avere una forma che possa adattarsi al sito attivo ed è legato all’enzima da
forze relativamente deboli.
La specificità di un substrato è elevata, (ad es. un enzima è in grado di
discriminare tra prodotti simili, ma allo stesso tempo chimicamente diversi,
come gli isomeri ottici), ma non assoluta.
COENZIMI
[E1]
Alcuni enzimi per la loro
attività non hanno bisogno del supporto di altri gruppi chimici se non quelli
dei loro residui amminoacidici. Altri necessitano di componenti chimici
addizionali, che coadiuvano l’enzima nella catalisi trasportando l’atomo o
la molecola interessata nella reazione, e si chiamano COFATTORI. Essi
possono essere:
-
METALLI (generalmente cationi bivalenti): Zn++,
Mn++, Fe++, Cu++, Co++, Mg++,
Ca++
-
COENZIMI: generalmente vitamine e derivati vitaminici
I coenzimi sono molecole
non proteiche che spesso funzionano come trasportatori di elettroni. In ogni
tipo di cellula ci sono parecchi tipi diversi di coenzimi, ognuno dei quali è
capace di tenere gli elettroni ad un livello di energia lievemente differente.
Un coenzima può accettare elettroni in un passaggio particolare di una serie di
reazioni e cederli poi in un altro passaggio della stessa serie o di un’altra
diversa, attraverso reazioni redox. Questa combinazione di enzimi che lavorano
insieme e trasportatori di elettroni, permette alla cellula di catturare
efficacemente l’energia man mano che gli elettroni passano da livelli energetici
più alti a quelli più bassi.
Es. coenzimi trasportatori di
H
▪
NADH + H+ <==>
NAD+ + H2
▪ FADH2
<==>
FAD + H2
▪
Coenzima A (trasporta acetili): CoA + gruppo acetilico =
acetilcoenzimaA
I COFATTORI possono
interagire con l’enzima secondo due modalità, dall’esterno (es. NAD) oppure
essere coniugati ad esso (es. FAD o i metalli). In quest’ultimo caso prendono il
nome di GRUPPO PROSTETICO.
OLOENZIMA = APOENZIMA
+
GRUPPO PROSTETICO
OLOENZIMA:
Enzima cataliticamente attivo, con tutti i suoi coenzimi o ioni metallici
APOENZIMA:
Parte proteica di un enzima
GRUPPO PROSTETICO:
Parte non amminoacidica