|
transizione di fase.
Occupiamoci ora brevemente delle trasformazioni fra diverse fasi:
gasliquido condensazione
liquidogas evaporazione
liquidosolido solidificazione
solidoliquido fusione
solidogas sublimazione
evaporazione
Consideriamo una colonna di mercurio e capovolgiamola in una vaschetta di mercurio; nella parte superiore si presentano vapori di mercurio estremamente rarefatti. Supponiamo di far passare nella colonna di mercurio un liquido molto volattile (ad esempio: etere). Che cosa succede? Sostanzialmente, avviene che le prime particelle di etere salgono in superficie e si trasformano in vapore abbassando la pressione barometrica. Dopodichè, l’etere sale in superficie e si determina un equilibrio fra la fase gassosa e la fase liquida e quindi la pressione esercitata dal vapore di etere diventa costante.
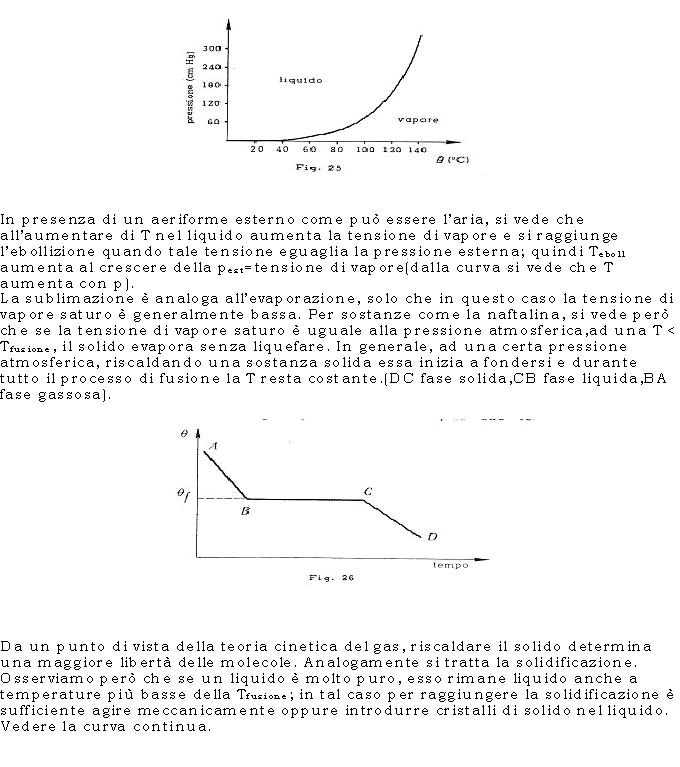
L’evaporazione può essere spiegata nel seguente modo: le molecole del liquido che “scappano” devono presentare Ec >>Ecmedia; una volta evaporate, è chiaro che la temperatura del liquido si abbassa leggermente perché diminuisce l’ Ecmedia. La condensazione avviene al contrario; si pensi –ad esempio- ad un recipiente chiuso in cui sono presenti sia fase liquida che fase gassosale molecole di gas urtando perdono energia cinetica e quindi sono catturate dal liquido. Raggiunto l’equilibrio fra fase gassosa e fase liquida, il vapore è detto saturo e la pressione che esercita è detta tensione di vapore saturo(è chiaro che al crescere di T “scappono” più molecole dal liquido e quindi aumenta la tensione di vapore saturo) .In un diagramma (p,T) possiamo riportare la curva di equilibrio fra fase liquida e fase gassosa (essa separa la parte liquida dalla parte in cui il vapore non è saturo); per T>Tc non c’è più fase liquida.
 28/57
28/57

|