|
Combustione
La combustione ¨¨ una
reazione chimica di ossidazione, fra un combustibile ed un comburente
(in genere l¡¯ossigeno), con sviluppo di energia termica (ovvero
¨¨ una reazione esotermica). Da questa reazione si generano
nuovi componenti, i prodotti della combustione. La conoscenza del
fenomeno della combustione ha un enorme importanza sia in termini di
risparmio energetico che ecologico, per l¡¯inquinamento
atmosferico prodotto dai fumi.
La reazione di combustione
Gli elementi chimici contenuti
nei combustibili fossili che reagendo con l¡¯ossigeno danno
luogo a reazioni esotermiche sono, principalmente, il carbonio,
l¡¯idrogeno e lo zolfo:
C
+ O2
= CO2
+ 34.03 MJ/(kg di C)
4H
+ O2
= 2H2O
+144.42 MJ/(kg di H2)
S
+ O2
= SO2
+ 10.88 MJ/(kg di S)
Durante il processo di
combustione la massa di ciascun elemento rimane invariata per cui pu¨°
essere eseguito un bilancio di massa che nel caso della reazione di
ossidazione del carbonio fornisce:
12
kg di C + 32 kg di O = 44 kg di CO2
Quindi, 1 kg di carbonio puro per
una combustione stechiometricamente completa richiede 32/12=2.667 kg
di ossigeno. Essendo poi l¡¯aria costituita da circa il 23,2 %
in massa da ossigeno per la combustione di 1 kg di carbonio ¨¨
necessario, teoricamente, 2.667/0.232=11.56 kg di aria. Procedendo in
modo analogo si trova che per la combustione di 1 kg di idrogeno puro
sono necessari 34.48 kg di aria, mentre per 1 kg di zolfo puro sono
necessari 4.31 kg di aria.
Si
definisce aria
teorica,
at,
la minima quantit¨¤ di aria necessaria per far avvenire la
combustione completa di 1 kg di combustibile. Ovviamente questa
grandezza dipende unicamente dalla composizione del combustibile e
pu¨° essere determinata attraverso la seguente formula:
at = ma,t/mc = 11,56xC + 34,48xH + 4,31xS -4,31xO
dove le x rappresentano,
rispettivamente, la frazione in massa di carbonio, idrogeno, zolfo ed
ossigeno presenti nel combustibile.
A
causa del non perfetto mescolamento dei reagenti, l¡¯aria
teorica non ¨¨ sufficiente a portare a termine completamente la
reazione di combustione: ¨¨ pertanto necessario aggiungere un
eccesso d¡¯aria. Si ottiene cos¨¬ il valore della
cosiddetta
aria pratica
ap = ma,p/mc = n at (2)
In
genere n,
detto indice
d¡¯aria,
varia tra 1 e 1.5 a seconda della conformazione del bruciatore (tanto
pi¨´ esso ¨¨ sofisticato tanto pi¨´ n ¨¨
prossimo a 1), ma pu¨° arrivare fino a 3.5 qualora si voglia
limitare la temperatura di combustione, ad es. per non danneggiare
gli organi delle macchine o per ridurre la formazione di ossidi di
azoto. Di solito il valore di n viene regolato dall¡¯analisi (in
continuo per i grandi impianti, o periodica) dei prodotti di
combustione. In alcuni casi ¨¨ possibile incontrare in
letteratura il cosiddetto eccesso
d¡¯aria
definito come:
e = (ap-at) / at (3)
L¡¯eccesso
d¡¯aria e l¡¯indice d¡¯aria sono legati tra loro dalla
relazione: e
= n¨C1
(un indice d¡¯aria pari a 1.1 equivale ad un eccesso d¡¯aria
del 10 %).
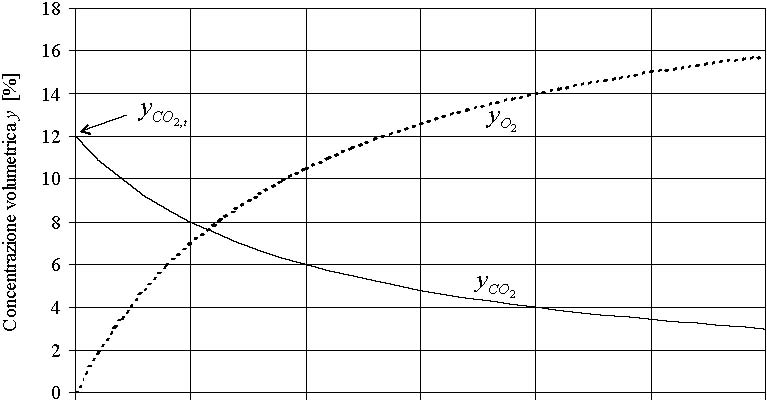
In
figura 1 viene riportato l¡¯andamento qualitativo della frazione
in volume di CO2
(yCO2)
e di O2
(yO2)
presenti nei fumi secchi in funzione dell¡¯indice d¡¯aria
n. La misura di queste grandezze, effettuata dagli analizzatori dei
prodotti di combustione, ¨¨ importante perch¨¦ correla
l¡¯eccesso d¡¯aria (n-1) al rendimento della combustione.
E¡¯ evidente che all¡¯aumentare dell¡¯eccesso d¡¯aria,
restando costante il volume di CO2,
la percentuale di CO2
nei fumi diminuisce, mentre quella di ossigeno aumenta. Il valore
dell¡¯indice d¡¯aria si pu¨° ottenere dalla misura
della concentrazione residua di ossigeno nei fumi, yO2,
tramite la formula seguente
n = 0,21/(0,21 - yO2) (4)
1.0
1.5 2.0 2.5 3.0 3.5 4.0
Indice
d'aria n
Figura
1:
Frazione volumetrica di CO2
e di O2
nei fumi secchi nel caso di metano (CH4).
Oltre all¡¯aria teorica,
esistono altre propriet¨¤ caratteristiche del combustibile le
pi¨´ importanti delle quali verranno brevemente riportate nel
seguito.
Il
potere calorifico superiore, Ps,
¨¨ la quantit¨¤ totale di calore sviluppata dalla
reazione di combustione completa dell¡¯unit¨¤ di massa del
combustibile e pu¨° essere approssimativamente valutato come:
Ps
≅34.03xC
+144.42xH
+10.88xS
[MJ/(kg
di combustibile)] (5)
Nella
combustione di combustibili contenenti idrogeno, nei fumi ¨¨
presente acqua allo stato di vapore; il passaggio dell¡¯acqua
dallo stato liquido allo stato di vapore comporta la perdita del
calore latente di vaporizzazione (circa 2500 kJ/kg) dal calore di
combustione. Il calore effettivamente disponibile per lo scambio
termico ¨¨ quindi solo quello sensibile e viene chiamato potere
calorifico inferiore, Pi
(circa il 10 % inferiore ad Ps).
Pi¨´ rigorosamente, il
potere calorifico ¨¨ definito come la differenza tra l¡¯entalpia
dei reagenti e quella dei prodotti in una reazione a temperatura e
pressione costante. Quindi esso dipende anche, seppur lievemente,
dalla temperatura del combustibile e dell¡¯aria e dallo stato di
aggregazione del combustibile.
Se la pressione parziale del
vapor d¡¯acqua nei fumi ¨¨, alla temperatura dei fumi,
uguale a quella di saturazione si ha la condensa (nella pratica
questo avviene anche quando i fumi sono a contatto con superfici a
temperatura inferiore a quella di rugiada). La condensa pu¨°
essere pericolosa per i combustibili che contengono zolfo in quanto
si ha formazione di acido solforico, corrosivo nei confronti
dell¡¯acciaio. E¡¯ questo il motivo per il quale,
generalmente, nelle caldaie industriali (tranne in quelle a
condensazione) il vapore d¡¯acqua contenuto nei fumi non viene
condensato. Dove non espressamente specificato si far¨¤,
quindi, riferimento sempre al potere calorifico inferiore. Tra il
potere calorifico superiore e quello inferiore vi ¨¨ la
relazione:
Pi
≅Ps
−2.5
mH
O
[MJ/(kg di combustibile)] (6)
2
dove
mH2O
¨¨ la massa di acqua formatasi in seguito alla combustione di 1
kg di combustibile.
La
temperatura di accensione
¨¨ la temperatura alla quale, in condizioni di pressione
atmosferica, il processo di combustione della miscela stechiometrica
(combustibile e comburente) avviene in modo stabile. Si comprende,
quindi, Si comprende come la combustione per innescarsi abbia bisogno
della presenza contemporanea di tre fattori: il combustibile, il
comburente ed il calore. Una volta innescata la reazione di
combustione, la fiamma deve essere mantenuta ad una temperatura
superiore a quella minima di accensione. Se nella regione della
fiamma la miscela in fase di combustione viene raffreddata ad un
valore di temperatura inferiore a quella di accensione, il processo
di combustione si arresta e la fiamma si spegne.
La
temperatura teorica di combustione
¨¨ la temperatura raggiunta dai prodotti della combustione
quando questa ¨¨ completa ed avviene adiabaticamente. La
temperatura di combustione dipende dal potere calorifico e dall¡¯aria
pratica e si determina con buona approssimazione come
Tf = Ta + Hi/(cp,f n at)
(7)
dove
cp,f
¨¨
il calore specifico dei fumi (circa 1.1 kJ/kgK) e Ta
la temperatura dell¡¯aria in ingresso. Tf
oscilla in pratica tra 1200 e 2000 ¡ãC, a seconda del combustibile
e dell¡¯indice d¡¯aria. Da notare che localmente la
temperatura di fiamma pu¨° anche eccedere il valore su
indicato, favorendo cos¨¬ la produzione di ossidi di azoto. Al
contrario, i fenomeni di dissociazione (ovvero la separazione di
molecole complesse in molecole o radicali pi¨´ semplici, dovuta
all¡¯alta temperatura), che assorbono energia, possono ridurre
la temperatura effettiva di combustione.
I
combustibili possono essere definiti come sostanze capaci di produrre
energia termica a seguito di una reazione chimica di combustione. I
combustibili attualmente pi¨´ noti sono i
combustibili
fossili
o naturali che vengono utilizzati dopo opportuni trattamenti. Come si
pu¨° osservare dalla figura 2, i combustibili fossili
contribuiscono per circa l¡¯85-86 % sui consumi energetici
mondiali. Per quanto riguarda l¡¯Italia la dipendenza energetica
dai combustibili fossili risulta pi¨´ marcata: nel 1998 si ¨¨
avuto un consumo energetico pari a circa 200 Mtep di cui il 54 % da
prodotti petroliferi, il 28 % da gas naturale, il 6 % da combustibili
solidi (carbone) ed il restante 12 % da fonti rinnovabili (quasi
tutto idroelettrico) e dall¡¯importazione dell¡¯elettricit¨¤.
Di questi 200 Mtep, un terzo ¨¨ stato consumato dai trasporti,
un terzo dagli usi civili ed un terzo dall¡¯industria.

Figura
2: Consumo mondiale di energia primaria (Official Energy Statistics
from the U.S. Government).
I
combustibili commerciali si distinguono in genere in solidi, liquidi
e gassosi. Tranne poche eccezioni, i combustibili hanno una
composizione chimica prefissata: la loro composizione (e quindi anche
il loro potere calorifico) varia a seconda del processo produttivo o
della zona di estrazione.
Tra i
combustibili solidi si annoverano la legna, i carboni
(lignite, antracite, litantrace, coke), e quelli non convenzionali:
rifiuti solidi urbani (RSU), sanse, vinacce, destinati ad usi
industriali.
I
combustibili liquidi sono in genere miscele di idrocarburi: le
benzine, il gasolio, il kerosene, gli oli combustibili, che
contengono frazioni via via pi¨´ pesanti dei prodotti liquidi
ottenuti dalla distillazione o dalla lavorazione del petrolio.
I combustibili liquidi si distinguono a seconda del tenore di zolfo
in ATZ (alto tenore di zolfo, < 3 %) BTZ (basso tenore di zolfo <
1 %), STZ (senza tenore di zolfo < 0.3 %, ammesso per usi civili).
Nessun
combustibile liquido ¨¨ costituito da un unico componente:
tuttavia in prima approssimazione si pu¨° considerare la
benzina come costituita unicamente da ottano (C8H18) e il gasolio
come costituito da dodecano (C12H26). I combustibili liquidi sono
caratterizzati dalla curva di distillazione, che indica per ogni
temperatura la frazione che ¨¨ convertita in vapore. Ad esempio
la benzina inizia a vaporizzare a 40-50 ¡ãC ed ¨¨
completamente convertita in vapore a 200 ¡ãC, mentre il gasolio
distilla indicativamente tra i 200 ed i 350 ¡ãC.
I
combustibili gassosi annoverano i GPL o gas di petrolio liquefatti
(miscele di propano e butano ed altri prodotti leggeri di
distillazione del petrolio, che sottoposti a moderate pressioni ¨C
circa 10 bar ¨C passano allo stato liquido e sono contenuti in
bombole), il gas di citt¨¤ (miscela di idrogeno, metano e
monossido di carbonio prodotto dalla distillazione o dalla
gassificazione del carbone) il gas naturale (quasi integralmente
metano, che ha sostituito il gas di citt¨¤). Altri gas come
l¡¯acetilene ed il gas d¡¯altoforno (monossido di carbonio)
hanno impieghi unicamente industriali.
Emissioni di sostanze
inquinanti
I
prodotti della combustione sono essenzialmente acqua (H2O)
ed anidride carbonica (CO2). Sono presenti anche ossidi di
zolfo in dipendenza dal tenore di questo elemento nel combustibile:
dato che gli SOx sono altamente inquinanti, si cerca di
ridurre a monte il tenore di zolfo nei combustibili stessi. Gli
ossidi di azoto (NOx) compaiono a causa della ossidazione
ad elevata temperatura dell¡¯azoto contenuto nell¡¯aria
comburente. Quando manca la giusta quantit¨¤ di aria per far
avvenire la combustione completa, nei fumi generati dal processo di
combustione possono essere presenti degli elementi incombusti tra i
quali il monossido di carbonio, altamente pericoloso per l¡¯uomo:
2C
+ O2
= 2CO + 10.25 MJ/(kg di C)
La
presenza degli incombusti (CO ed HC) tra i prodotti della combustione
comporta inoltre una minore quantit¨¤ di calore generato a
parit¨¤ di consumo di combustibile (un contenuto di CO dell¡¯1%
nei fumi comporta una perdita energetica di circa il 4%). Altri
prodotti (ceneri, polveri sospese, metalli, etc.) dipendono dal tipo
e dalle impurezze del combustibile ed il loro studio esula dallo
scopo di questa trattazione.
Le
sostanze inquinanti emesse in atmosfera dagli impianti di combustione
sono responsabili di diversi problemi ambientali, alcuni gi¨¤
evidenti altri ritenuti potenzialmente molto pericolosi: piogge
acide, effetto serra, buco dell¡¯ozono stratosferico, agli
episodi di degrado della qualit¨¤ dell¡¯aria che hanno
riflessi diretti sulla vita dell¡¯uomo. Le emissioni di
inquinanti da impianti di combustione possono essere classificati
come dipendenti da:
combustibile:
se questo contiene una sostanza inquinante che rimane inalterata o
se contiene una sostanza che a seguito della combustione si
trasforma producendo composti inquinanti (SOx ed NOx);
combustione
anomala: quando la combustione ¨¨ incompleta si
generano sostanze non completamente ossidate (ad es. CO, idrocarburi
incombusti) e se la combustione non ¨¨ ben controllata si pu¨°
avere formazione di ossidi di azoto (NOx)
di origine termica, cio¨¨ legata alla modalit¨¤ con cui
avviene la combustione (alta temperatura delle fiamme);
combustione
normale: anche se la combustione risulta essere normale
si ha emissione di anidride carbonica (CO2)
che provoca l¡¯effetto serra.
Il D.M.
12/07/90 in materia di emissioni di inquinanti dagli impianti di
combustione, pone dei limiti alle concentrazioni dei singoli
inquinanti nel punto in cui sono emessi (v. tabella 1) che risultano
un compromesso tra lo sviluppo tecnologico, le esigenze sanitarie e
le effettive possibilit¨¤ di misura.
Limiti
pi¨´ restrittivi alle emissioni dei grandi impianti di
combustione (quelli con potenza termica uguale o superiore ai 50 MW)
sono previsti da due nuove direttive europee 2001/80/CE e 2001/81/CE,
che a partire dal 27 novembre 2002 (data entro la quale dovranno
essere attuate) obbligheranno gli stati membri ad un graduale
abbassamento delle emissioni inquinanti prodotte nei propri territori
fino a raggiungere, nel giro di pochi anni, il rispetto dei precisi
valori limite elencati negli allegati di tali direttive.
|
INQUINANTE
|
Potenza nominale minore di 50 MW
|
Potenza nominale compresa tra 50 MW e 500 MW
|
Potenza nominale superiore a 500 MW
|
|
OLIO
|
GAS
|
|
CO
|
-
|
-
|
250
|
250
|
|
HC
|
150
|
150
|
300
|
300
|
|
NOx
|
500
|
350
|
650
|
200
|
|
SO2
|
1700
|
35
|
1700
|
400
|
|
POLVERI
|
100
|
5
|
50
|
50
|
Tabella
1: Limite di legge (D.M. 12/07/90) alle emissioni (mg/m3) per
impianti convenzionali esistenti nel 1988.
La
composizione di una miscela gas pu¨° essere espressa come
concentrazione in volume: questa ¨¨ il rapporto tra il volume
che il gas occuperebbe da solo alla stessa pressione e temperatura
cui si trova nella miscela ed il volume totale di quest¡¯ultima.
Se il gas segue un comportamento ideale, la concentrazione in volume
corrisponde a quella in moli (moli di gas/moli totali). Inoltre,
sfruttando l¡¯equazione di stato dei gas ideali, si pu¨°
dimostrare che la concentrazione in volume ¨¨ pari alla
pressione parziale del gas all¡¯interno della miscela (ovvero la
pressione che il gas avrebbe se occupasse da solo l¡¯intero
volume a disposizione). Gli inquinanti gassosi sono spesso misurati
mediante analizzatori che forniscono la concentrazione in volume,
mentre la legge fornisce limiti alla concentrazione in massa. La
concentrazione in massa di un inquinante (i-esimo) nei fumi si
esprime generalmente come massa di inquinante (mi)
per unit¨¤ di volume dei fumi (Vf) in
condizioni di riferimento. Questo per evitare che si possano
artificiosamente ¡°diluire¡± gli inquinanti aggiungendo
aria di combustione in eccesso.
Pertanto
le ¡°condizioni di riferimento¡± secondo il D.M. 12/07/90
fissano un limite al tenore residuo di ossigeno nei fumi (3 % per i
combustibili liquidi e gassosi, 6 % per il carbone ed 11 % per gli
altri combustibili solidi). Per passare dalla concentrazione in
volume (Vi/Vf) alla concentrazione in massa
(mi/Vf) si pu¨° scrivere:
mi/Vf = (miVi)/(Vf Vi) = ¦ÑiVi/Vf
(8)
dove
¦Ñi
¨¨
la densit¨¤
dell¡¯inquinante i ed ¨¨ calcolabile con buona
approssimazione con la legge di Avogadro se l¡¯inquinante ¨¨
gassoso: si ricorda tale legge afferma che una kg-mole di sostanza
(la cui massa in kg ¨¨ numericamente pari al valore del peso
molecolare) occupa in condizioni normali (1 atm e 25 ¡ãC) il
volume di 22.4 m3.
La concentrazione da confrontare con i limiti di legge non ¨¨
quella misurata, ma ¨¨ quella riportata nelle condizioni di
riferimento:
mi/Vf = (miVfr)/(Vfr Vf) = (mi/Vf r) [ miVf r(1 + nr at)]/[VfrVf (1 + nr at)]
(9)
dove:
Vfr
= volume dei fumi con indice d¡¯aria di riferimento;
mi
/Vfr
= concentrazione in condizione di riferimento;
n
= indice effettivo di aria;
nr
indice d¡¯aria in condizioni di riferimento.
BIBLIOGRAFIA
P. Anglesio, ¡°Elementi di
Impianti Termotecnici¡±, Pitagora Editrice, Bologna, 1998.
G.
Cornetti, ¡°Macchine a fluido¡±, Edizioni il Capitello,
Torino, 1996.
P.
Andreini, F. Pierini, ¡°La conduzione dei generatori di
vapore¡±, Hoepli, Milano, 1995.
R.
della Volpe, ¡°Macchine¡±, Liguori Editore, Napoli, 1994.
D.M.
12 luglio 1990, ¡°Linee guida per il contenimento delle
emissioni inquinanti degli impianti industriali e la fissazione dei
valori minimi di emissione¡±.
Direttiva
2001/81/CE, ¡°Limiti nazionali di emissione in atmosfera di
biossido di zolfo, ossidi di azoto, componenti organici volatili,
ammoniaca¡±.
Direttiva 2001/80/CE,
¡°Limitazioni alle emissioni in atmosfera degli inquinanti dei
grandi impianti di combustione¡±.
D.P.R.
203/1988, ¡°Attuazione delle direttive CEE numeri 80/779,
82/884, 84/360 e 85/203 concernenti norme in materia di qualit¨¤
dell¡¯aria, relativamente a specifici agenti inquinanti, e di
inquinamento prodotto dagli impianti industriali, ai sensi
dell¡¯articolo 15 della legge 16 aprile 1987, n. 183¡±.
D,M.
12 luglio 1990, ¡°Linee guida per il contenimento delle
emissioni inquinanti degli impianti industriali e la fissazione dei
valori minimi di emissione¡±.
Legge
9 gennaio 1991, n.10 (nota come legge 10/91), ¡°Norme in
materia di uso razionale dell¡¯energia, di risparmio energetico
e di sviluppo delle fonti rinnovabili di energia¡±.
D.P.R.
26 agosto 1993, n. 412, ¡°Regolamento recante norme per la
progettazione, l¡¯installazione, l¡¯esercizio e la
manutenzione degli impianti termici degli edifici ai fini del
contenimento dei consumi di energia, in attuazione dell¡¯art.
4, comma 4, della legge 10/91¡±.
D.P.R. 21 dicembre 1999, n.551,
¡°Regolamento recante modifiche al D.P.R. 26 agosto 1993, n.
412¡±.
Sito
della Regione Lombardia:
www.ambiente.regione.lombardia.it/inemar/inv_emis.htm.
Sito
U.S dell¡¯Energy Information Administration:
www.eia.doe.gov.
Link
Francese
http://fr.wikipedia.org/wiki/Combustion
http://fr.wikipedia.org/wiki/Pouvoir_calorifique
http://fr.wikipedia.org/wiki/Combustible
http://fr.wikipedia.org/wiki/Ressources_et_consommation_%C3%A9nerg%C3%A9tiques_mondiales
http://www.geocities.com/CapeCanaveral/9305/comb.htm
http://www.futura-sciences.com/fr/comprendre/glossaire/definition/t/matiere-1/d/combustion_3790/
http://www.cmhc-schl.gc.ca/fr/co/enlo/vosavoma/quaiin/quaiin_004.cfm
http://www.dutry.com/lire/qualite-fumees.html
Inglese
http://en.wikipedia.org/wiki/Combustion
http://en.wikipedia.org/wiki/Heat_of_combustion
http://en.wikipedia.org/wiki/Fuel
http://en.wikipedia.org/wiki/World_energy_resources_and_consumption
http://en.wikipedia.org/wiki/Flue_gas_emissions_from_fossil_fuel_combustion
http://www.atmosphere.mpg.de/enid/3rq.html
http://www.chm.davidson.edu/ChemistryApplets/calorimetry/HeatOFCombustionOfMethane.html
http://en.wikipedia.org/wiki/Fuel_efficiency
Italiano
http://it.wikipedia.org/wiki/Combustione
http://it.wikipedia.org/wiki/Potere_calorifico
http://it.wikipedia.org/wiki/Combustibile
http://it.wikipedia.org/wiki/Consumo_di_energia_nel_mondo
http://www.rinnovabili.it/citta-il-punto-sulla-qualita-dellaria
http://staff.nt2.it/michele/parola_108_combustione.aspx
http://enciclopedia.ws/topic/Combustione.html
http://ulisse.polito.it/matdid/1ing_mec_P3840_TO_0/2001-2002/Emissioni/em_di_form.pdf
http://www.geocities.com/greenw_2001/tesi_2.html
Portoghese
http://pt.wikipedia.org/wiki/Combust%C3%A3o
http://pt.wikipedia.org/wiki/Poder_calor%C3%ADfico
http://pt.wikipedia.org/wiki/Combust%C3%ADvel
http://pt.wikipedia.org/wiki/Consumo_de_energia
http://www.brasilescola.com/fisica/propriedades-dos-combustiveis.htm
http://www.apena.rcts.pt/aproximar/floresta/recursos/arvore_madeira/caderno3_3.htm
http://www.krona.srv.br/display05.htm
http://www.eciencia.usp.br/site_2005/exposicao/gepeq/combustao.htm
Spagnolo
http://es.wikipedia.org/wiki/Combusti%C3%B3n
http://es.wikipedia.org/wiki/Poder_calor%C3%ADfico
http://es.wikipedia.org/wiki/Combustible
http://html.rincondelvago.com/combustion_1.html
http://www.textoscientificos.com/quimica/combustion
http://www.textoscientificos.com/quimica/combustion
http://www.redproteger.com.ar/poder_calorifico.htm
http://www.textoscientificos.com/energia/combustibles/origen-clasificacion
|